|
|
|
|
|
香港, 2022年6月21日 - (亚太商讯) - 中国抗体制药有限公司(“中国抗体”或“公司”,连同其附属公司,统称“集团”;股份代号:3681.HK),一家专注于研究、开发、制造及商业化免疫疾病创新疗法的香港生物制药上市公司,主要研制以单克隆抗体为基础的生物药,欣然宣布,其旗舰产品SM03舒西利单抗(Suciralimab)的作用机理已于2022年6月10日在美国免疫领域权威期刊the Journal of Immunology上成功发表(论文链接:https://www.jimmunol.org/content/early/2022/06/10/jimmunol.2100820 )。
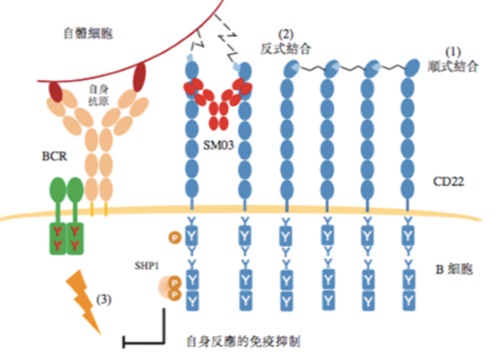 | | 图:舒西利单抗SM03(Suciraslimab)作用机理 |
The Journal of Immunology(the JI),于1916年创刊,由美国免疫学家协会管理和出版,是世界上免疫学领域的顶级同行评鉴刊物,5年影响因子为6.029(2020年期刊引文报告),发布免疫学领域在基础研究和临床研究上的和免疫相关的最新发现,同时发表免疫学领域的最新研究论文,包括细胞免疫学、免疫化学和分子免疫学、免疫遗传学和免疫调节、免疫病理学和临床免疫学、免疫药理学、微生物免疫学、肿瘤和移植。
公司旗舰产品舒西利单抗SM03(Suciraslimab)为全球首项用以治疗类风湿性关节炎的潜在抗CD22单抗。该产品已于2021年底在中国完成III期临床试验受试者入组,合计招募530例受试者。该试验为由中国医学科学院北京协和医院牵头的多中心临床研究,临床中心包括南京大学医学院附属鼓楼医院、哈尔滨医科大学附属第二医院、山西医科大学第一医院等44家医院。公司预计今年6月底进行锁库,8月初读出III期临床试验数据结果,并将于2023年申请新药上市(BLA)。此外,舒西利单抗(Suciraslimab)的研发也获得了863计划、“十二五”及“十三五”重大新药创制专项支持,且享受国家药品评审中心(CDE)“优先审评审批”绿色通道。此前,由北京协和医院领导的II期临床试验已验证舒西利单抗(Suciraslimab)对类风湿关节炎治疗有较好的疗效性及较高的安全性。
公司旗舰产品舒西利单抗(Suciraslimab)是全球首项用于治疗类风湿性关节炎的潜在抗CD22单抗。该产品与目前市场上现有标准疗法的核心竞争优势在于其新颖独特的作用机理,保证了舒西利单抗在与其他产品疗效相当的情况下,在安全性方面有显着的优势,而安全性正是长期用药的自身免疫疾病患者需要关注的核心问题。
在人体免疫系统正常运行的前提下,当外来抗原入侵时,B细胞受体通路会被激活,向B细胞传递抗原刺激信号,引发一系列B细胞免疫反应。而在面对自身抗原时,正常的机体会招募免疫抑制分子如SHP-1,通过阻止或是减弱B细胞受体通路向B细胞传递抗原刺激信号来抑制B细胞相关免疫反应。我们认为,通过转变CD22的结合方式,即CD22从顺式结合转变为反式结合可以达到招募这类免疫抑制分子,如SHP-1,进而达到抑制相关免疫反应的作用。
由于年龄或是遗传倾向等原因,RA等自身免疫疾病患者在面对自身抗原时,RA患者的CD22不能从顺式结合方式转变为反式结合,进而不能够招募例如SHP-1的免疫抑制分子来抑制或是减弱B细胞受体向B细胞内传递抗原刺激信号,B细胞接受到抗原刺激信号后,就会产生一系列免疫反应,如分泌大量抗体来攻击自身抗原。而我们的旗舰产品舒西利单抗(Suciraslimab)可以帮助CD22由顺式结合方式转变为反式结合,形成稳定的CD22反式结合结构,进而恢复B细胞对自身抗原的容忍度,抑制B细胞发生一系列相关免疫反应攻击自身机体。
通过历史数据与目前市场现有其他产品相比,舒西利单抗(Suciraslimab)在疗效相当的情况下,在安全性方面,相对其他产品有显着的优势。现有RA疗法从甲氨蝶呤(MTX)等传统合成改善病情抗风湿药(csDMARDs),到靶向肿瘤坏死因子(TNF)、白介素(IL)-6受体等靶点的生物制剂DMARDs(bDMARDs),以及靶向合成DMARDs(tsDMARDs),例如Janus激酶(JAK)抑制剂等小分子药物,这些新型药物的引入,对RA患者的病情缓解都起到了重要的作用。但是目前现有RA疗法的大部分作用机理都会导致B细胞的耗竭或是衰亡,对人体自身免疫系统都会产生一系列的副作用,这对需要长期用药的自免疾病患者来说存有长期隐患,免疫系统的衰弱自然而然的会引发其他衰竭性疾病的发生。但是舒西利单抗的作用机理却与目前市场的现有疗法截然不同,我们只是通过改变CD22的结合方式,招募相关抑制分子,进而抑制B细胞相关免疫反应,舒西利单抗只是通过调节B细胞的功能来抑制自身免疫反应,并未损伤到B细胞,不影响B细胞在免疫系统中发挥正常作用。因此,舒西利单抗在相对于目前市场上已有的其他产品,在安全性方面有显着的优势。
自身免疫疾病用药市场被誉为继肿瘤之后的下一个金矿。修美乐作为全球“药王”,雄踞全球药物榜首长达8年,2020年198.32亿美元的销售额令其他药品“俯首称臣”。放眼全球,制药巨头十分关注风湿免疫领域药物的研发,最突出的包括辉瑞、诺华、强生和艾伯维,管线中均有十余个在研或上市的产品。全球自身免疫疾病药物市场2018年的市场规模为1,137亿美元,且预计到2023年将达到1,523亿美元,复合年增长率为6.0%,中国自身免疫疾病药物的市场规模预计将从2018年的134亿元人民币增长到2030年的377亿元人民币,复合年增长率为23%。受全球创新浪潮的冲击,我国风湿免疫领域的研发热情同样高涨,恒瑞医药作为国内创新药龙头,在风湿免疫领域也采取了早布局、优靶点和广适应症等策略,希望能够充分享受国内自身免疫疾病市场快速发展的红利。可见中国抗体致力成为免疫性疾病及其他衰竭性疾病创新疗法的全球领导者的使命与愿景是迎合整个医药行业的发展趋势的,在可以预见的未来,相信中国抗体可以造福越来越多受自身免疫疾病困扰的患者,成为全球领先的以自身免疫疾病创新疗法为主的生物制药公司。
除旗舰产品舒西利单抗外,公司核心产品SN1011的适应症范围不断扩大,新药研究申请不断获得海内外监管机构的批准,也预计在今年快速启动天疱疮(PV)、多发性硬化症(MS)、系统性红斑狼疮(SLE)、视神经脊髓炎(NMOSD)的二期临床试验,主要产品SM17也在今年6月份在美国刚刚完成临床I期试验首例健康受试者给药,通过靶向Th2细胞相关炎性上游细胞因子通路的疗法,能够在较前端控制免疫级联反应引发的哮喘等炎性气道疾病,希望能够为广大未被满足治疗需求的严重不受控制的哮喘疾病患者带来福音。
关于中国抗体制药有限公司
中国抗体制药有限公司专注于研究、开发、制造及商业化免疫性疾病疗法。公司注重创新研发,其旗舰产品SM03为全球首项用以治疗类风湿关节炎的潜在抗CD22单抗,已在中国进入类风湿关节炎三期临床试验,并被列为国家十三五重大新药创制专项重大项目。此外还有多个同类靶点首创(First-in-target)及同类首创(First-in-class)在研药物,部分已处于临床阶段,适应症范围覆盖类风湿性关节炎、系统性红斑狼疮、寻常型天疱疮、非霍奇金氏淋巴瘤、哮喘等具有重大未满足临床需求的疾病。
Topic: Press release summary
Source: SinoMab BioScience Limited
Sectors: BioTech, Healthcare & Pharm
https://www.acnnewswire.com
From the Asia Corporate News Network
Copyright © 2026 ACN Newswire. All rights reserved. A division of Asia Corporate News Network.
|
|
|